 Este Sistema tiene su origen en la Ley General de Sanidad de 1986 la cual desarrolla el mandato constitucional del derecho a la protección de la salud y la encomienda a los poderes públicos de organizar y tutelar la salud pública a través de medidas preventivas y de las prestaciones y servicios necesarios.
Este Sistema tiene su origen en la Ley General de Sanidad de 1986 la cual desarrolla el mandato constitucional del derecho a la protección de la salud y la encomienda a los poderes públicos de organizar y tutelar la salud pública a través de medidas preventivas y de las prestaciones y servicios necesarios.Asimismo, el Sistema dispone de un amplio catálogo de prestaciones cuyo objeto es garantizar las condiciones básicas y comunes para una atención integral de calidad en el conjunto de los servicios, destacando entre ellas la prestación farmacéutica.
MINISTERIO DE SANIDAD, Y POLÍTICA SOCIAL (AHORA) LLEVABA, SEGÚN INDICAN USTEDES, QUE EL AGREAL-VERALIPRIDA EN ESPAÑA "FUÉ AUTORIZADO EN 1983".
¿QUÉ HICIERON USTEDES EN CUÁNTO A "EL DERECHO DE PROTECCIÓN DE LA SALUD" Y "TUTELAR LA SALUD PUBLICA" RESPECTO DEL "MEDICAMENTO AGREAL-VERALIPRIDA EN ESPAÑA"?.
POR SUPUESTISIMO QUE "NO HICIERON ABSOLUTAMENTE NADA".
SIGUE EL MINISTERIO DE SANIDAD DICIENDO EN ÉSTA FECHA:
Esta prestación se rige por lo dispuesto en la Ley 25/1990, de 20 de diciembre, del Medicamento, que supuso un hito de enorme importancia para el Sistema Nacional de Salud.
¿QUE "HITO DE ENORME IMPORTANCIA PARA EL SISTEMA NACIONAL DE SALUD, EN RELACIÓN AL MEDICAMENTO "AGREAL-VERALIPRIDA EN ESPAÑA" SUPUSO TAMBIEN ÉSTA LEY? NO CONTROL ALGUNO, NO MODIFICACIÓN PROSPECTO Y NO FICHA TÉCNICA; EN DEFINITIVA QUE USTEDES "LOS QUE POR EL MANDATO CONSTITUCIONAL DEL DERECHO A LA PROTECCIÓN DE LA SALUD" COMO SI EL "AGREAL-VERALIPRIDA EN ESPAÑA", NO ESTUVIERA AUTORIZADO, NO HICIERON ABSOLUTAMENTE NADA.
CONTINUA EL MINISTERIO DE SANIDAD EN OTROS DE LOS MUCHOS APARTADOS:
El Sistema Nacional de Salud español es un sistema ampliamente descentralizado y desde el año 2002 todas las Comunidades Autónomas disponen del conjunto de competencias sanitarias previsto en la normativa vigente. El Sistema se concibe como el conjunto de los servicios de salud de la Administración del Estado y de las Comunidades Autónomas convenientemente coordinados en beneficio de la salud de los ciudadanos.
La prestación farmacéutica, según el artículo 16 de la Ley 16/2003 de Cohesión y Calidad, comprende los medicamentos y productos sanitarios y el conjunto de actuaciones encaminadas a que los pacientes los reciban de forma adecuada a sus necesidades clínicas, en las dosis precisas según sus requerimientos individuales, durante el período de tiempo adecuado y al menor coste posible
para ellos y la comunidad.
¿NECESITÁBAMOS "LAS MUJERES DE ESPAÑA" EN EL CICLO DE LA MENOPAUSIA "UN POTENTE ANTIPSICÓTICO COMO ERA EL "AGREAL-VERALIPRIDA" PARA PALIAR LOS SOFOCOS?.
¿QUE NECESIDADES CLÍNICAS TENÍAMOS LAS MUJERES ESPAÑOLAS PARA QUE DE FORMA "INDISCRIMINADA" TOMARAMOS ESE "POTENTE ANTIPSICÓTICO"?.
LA INMENSA "MAYORÍA DE MUJERES" NINGUNA.
POR TANTO, EN ESTE APARTADO: TAMPOCO HICIERON NADA CON EL "AGREAL.VERALIPRIDA EN ESPAÑA".
CONTINUAREMOS, NO TIENE NINGÚN DESPERDICIO, ÉSTO QUE LES ESTAMOS RELATANDO.
¡¡¡ YA ENTENDEMOS LAS LUCHADORAS DEL AGREAL DE ESPAÑA, QUE EL MINISTERIO DE SANIDAD ESPAÑOL "NO SABE NO CONTESTA RESPECTO A LA "MASACRE" QUE HIZO CON NOSOTRAS!!!!




















 __________________________________________________
__________________________________________________ __________________________________________________
__________________________________________________ Tras la unión de un receptor acoplado a proteína G (GCPR) el estado conformacional del complejo ternario puede producir diferentes tipos de respuesta según las características del ligando y del estado conformacional del receptor y la proteína G a la que se ha acoplado: agonismo, falta de respuesta o agonismo parcial (impidiendo la acción de otros agonistas). Nótese que el antagonista en todos los casos se comporta de la misma manera. __________________________________________________
Tras la unión de un receptor acoplado a proteína G (GCPR) el estado conformacional del complejo ternario puede producir diferentes tipos de respuesta según las características del ligando y del estado conformacional del receptor y la proteína G a la que se ha acoplado: agonismo, falta de respuesta o agonismo parcial (impidiendo la acción de otros agonistas). Nótese que el antagonista en todos los casos se comporta de la misma manera. __________________________________________________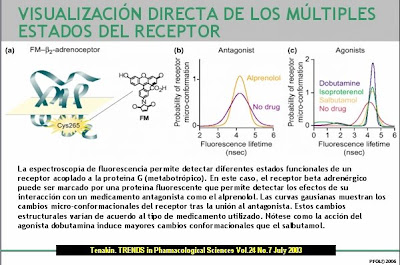 __________________________________________________
__________________________________________________ __________________________________________________
__________________________________________________ El Ácido gama amino butírico (GABA) es un producto del metabolismo del glutamato que posee todas las características propias de los neurotransmisores: se almacena en vesículas, se libera tras la despolarización sináptica, se une a receptores postsinápticos y presinápticos, puede ser recaptado por proteínas transportadoras en la membrana presináptica y es metabolizado por enzimas especializadas en células de la glia.
El Ácido gama amino butírico (GABA) es un producto del metabolismo del glutamato que posee todas las características propias de los neurotransmisores: se almacena en vesículas, se libera tras la despolarización sináptica, se une a receptores postsinápticos y presinápticos, puede ser recaptado por proteínas transportadoras en la membrana presináptica y es metabolizado por enzimas especializadas en células de la glia.
 En resúmen. Diferentes sistemas de neurotransmisión actúan en conjunto provenientes de diversas áreas subcorticales para regular las funciones corticales como la integración de la información, la cognición, el pensamiento, el afecto, al emoción, etc.
En resúmen. Diferentes sistemas de neurotransmisión actúan en conjunto provenientes de diversas áreas subcorticales para regular las funciones corticales como la integración de la información, la cognición, el pensamiento, el afecto, al emoción, etc. Enzimas especializadas son indispensales en la formación de nuevos neurotransmisores como las aminas. La tirosina hidroxilasa permite la formación de dopamina; la dopamina beta hidroxilasa, la formación de noradrenalina y la triptófano hidroxilasa, la formación de serotonina.
Enzimas especializadas son indispensales en la formación de nuevos neurotransmisores como las aminas. La tirosina hidroxilasa permite la formación de dopamina; la dopamina beta hidroxilasa, la formación de noradrenalina y la triptófano hidroxilasa, la formación de serotonina. Como se dijo, la interacción de múltiples sistemas de neurotransmisión permite la modulación de su actividad. Es por eso que encontramos receptores noradrenérgicos en terminales serotoninérgicas o receptores serotoninérgicos en terminales GABAérgicas, por ejemplo.
Como se dijo, la interacción de múltiples sistemas de neurotransmisión permite la modulación de su actividad. Es por eso que encontramos receptores noradrenérgicos en terminales serotoninérgicas o receptores serotoninérgicos en terminales GABAérgicas, por ejemplo. Las vías noradrenérgicas proceden del locus ceruleus en la protuberancia y tienen una proyección similar descrita para la serotonina.
Las vías noradrenérgicas proceden del locus ceruleus en la protuberancia y tienen una proyección similar descrita para la serotonina. Las vías serotoninérgicas proceden de los núcleos del rafe en la protuberancia y se proyectan hacia la médula espinal regulando varias funciones vegetativas como las gastrointestinales) o se proyectan hacia la corteza cerebral y estructuras subcorticales regulando funciones cognoscitivas y afectivas.
Las vías serotoninérgicas proceden de los núcleos del rafe en la protuberancia y se proyectan hacia la médula espinal regulando varias funciones vegetativas como las gastrointestinales) o se proyectan hacia la corteza cerebral y estructuras subcorticales regulando funciones cognoscitivas y afectivas. (a) La cantidad de neurotransmisores contenidos en una vesícula está influenciado por la concentración del mismo en la terminal presináptica y (b) por la eficiencia y eficacia del transportador vesicular. (c) El aumento en el contenido de neurotransmisores llevará al alargamiento de la vesícula para mantener una concentración de ellos constante. (d) El número de vesículas fusionadas y (e) la velocidad de descarga de los neurotransmisores controlará la concentración de éstos en el espacio sináptico. Por último, la concentración de los neurotransmisores cerca de la superficie del receptor postsináptico está determinada por (g) el tamaño de la hendidura sináptica y (f) la posición del grupo de receptores.
(a) La cantidad de neurotransmisores contenidos en una vesícula está influenciado por la concentración del mismo en la terminal presináptica y (b) por la eficiencia y eficacia del transportador vesicular. (c) El aumento en el contenido de neurotransmisores llevará al alargamiento de la vesícula para mantener una concentración de ellos constante. (d) El número de vesículas fusionadas y (e) la velocidad de descarga de los neurotransmisores controlará la concentración de éstos en el espacio sináptico. Por último, la concentración de los neurotransmisores cerca de la superficie del receptor postsináptico está determinada por (g) el tamaño de la hendidura sináptica y (f) la posición del grupo de receptores. La comunicación sináptica consiste en la transmisión electroquímica de señales entre dos o más neuronas. Para ello, la despolarización de la neurona presináptica permite la liberación de los neurotransmisores almacenados en las vesículas presinápticas. Los neurotransmisores se unirán a receptores post o presinápticos y serán recapturados por proteínas transportadoras presinápticas para ser realmacenados en las vesículas o destrudos por enzimas.
La comunicación sináptica consiste en la transmisión electroquímica de señales entre dos o más neuronas. Para ello, la despolarización de la neurona presináptica permite la liberación de los neurotransmisores almacenados en las vesículas presinápticas. Los neurotransmisores se unirán a receptores post o presinápticos y serán recapturados por proteínas transportadoras presinápticas para ser realmacenados en las vesículas o destrudos por enzimas.


