ImprimirAGREAL® 100 mg gélules (véralipride).FORME et PRESENTATION Gélule (verte) : boîte de 20, sous plaquette thermoformée (PVC/alu)COM

POSITION Véralipride (DCI) : 100 mg par gélule, soit 2 g par boîteExcipients : lactose, amidon, cellulose microcristalline, laurylsulfate de sodium, méthylcellulose, talc,stéarate de magnésium. Enveloppe de la gélule : gélatine, oxyde de titane, indigotine, jaune dequinoléine. Calibrage : n° 2.Teneur en sodium : 82 µg.
INDICATIONS THERAPEUTIQUES Traitement des bouffées vasomotrices invalidantes associées aux manifestations psycho-fonctionnellesde la ménopause confirmée.
POSOLOGIE ET MODE D’ADMINISTRATION Voie orale. Réservé à l’adulte.La posologie est de 100 mg, soit une gélule par jour, par cure de 20 jours par mois.La durée du traitement est limitée à 3 mois.
CTJ : 0,42 €.
CONTRE INDICATIONS Ce médicament est CONTRE-INDIQUE dans les cas suivants :- hypersensibilité au véralipride ou à l’un des constituants du produit ;- tumeur prolactino-dépendante connue ou suspectée, par exemple, adénome hypophysaire àprolactine ;- phéochromocytome, connu ou suspecté ;- en association aux agonistes dopaminergiques (amantadine, apomorphine, bromocriptine,cabergoline, entacapone, lisuride, pergolide, piribédil, pramipexole, quinagolide, ropinirole)(voir interactions) ;- en association aux neuroleptiques antipsychotiques et aux neuroleptiques antiémétiques (voirInteractions ;- maladie de Parkinson.
MISES EN GARDE ET PRECAUTIONS PARTICULIERES D’EMPLOIAGREAL est un NEUROLEPTIQUE. Il peut entraîner des dyskinésies et des syndromesparkinsoniens. Il est alors impératif d’arrêter le traitement.Agréal n'est pas un traitement substitutif estrogénique. Il ne corrige pas l'hypoestrogénieménopausique et ne peut en aucun cas constituer un traitement des effets de cette carence, enparticulier sur les muqueuses génitales et sur l'os.Effets de classe- Syndrome malin : comme avec les autres neuroleptiques, la survenue d’un syndrome malin(hyperthermie, rigidité musculaire, troubles neurovégétatifs, altération de la conscience, augmentationdes CPK) est possible. En cas d’hyperthermie, en particulier avec des doses journalières élevées, letraitement doit être interrompu.- Allongement de l’intervalle QT : cet effet, connu pour potentialiser le risque de survenue de troublesdu rythme ventriculaire grave à type de torsades de pointes, est majoré par l’existence d’unebradycardie (inférieure à 55 battements par minute), d’une hypokaliémie, d’un QT long congénital ouacquis (association à un médicament augmentant l’intervalle QT).
Il convient donc de s’assurer avant toute administration de l’absence de facteur pouvant favoriser la
survenue de ces troubles du rythme.
Il est recommandé d’effectuer un ECG dans le bilan initial des patients devant être traités par un
neuroleptique.
- Des dyskinésies tardives ont été observées au cours de cures prolongées, les antiparkinsoniens
anticholinergiques sont sans action ou peuvent provoquer une aggravation.
- Une surveillance mammaire est recommandée en raison du risque de survenue d’hyperprolactinémie
chez certaines patientes.
Un syndrome de sevrage avec ou sans anxiété, un syndrome dépressif avec ou sans anxiété, voire une
anxiété isolée peuvent survenir entre 2 cures ou à l’arrêt du traitement. Le traitement doit être repris,
puis interrompu progressivement.
La surveillance du traitement par véralipide doit être renforcée :
- chez les sujets ayant des antécédents de crises convulsives en raison de la possibilité d’abaissement
du seuil épileptogène ;
- chez le sujet âgé présentant une plus grande sensibilité à l’hypotension orthostatique et à la sédation.
En l’absence de données, ce médicament est déconseillé en cas d’insuffisance rénale.
En raison de la présence de lactose, le médicament ne doit pas être utilisé en cas de galactosémie
congénitale, de syndrome de malabsorption du glucose et du galactose ou de déficit en lactase.
INTERACTIONS AVEC D’AUTRES MEDICAMENTS ET AUTRES FORMES
D’INTERACTIONS
Associations contre-indiquées :
• les agonistes dopaminergiques (amantadine, apomorphine, bromocriptine, cabergoline,
entacapone, lisuride, pergolide, piribédil, pramipexole, quinagolide, ropinirole)
Antagonisme réciproque de l’agoniste dopaminergique et des neuroleptiques.
•
Neuroleptiques antipsychotiques
• Neuroleptiques antiémétiques
Augmentation des effets indésirables neurologiques et psychologiques.
Association déconseillée :
• Alcool : majoration par l’alcool de l’effet sédatif des neuroleptiques. L’altération de la vigilance
peut rendre dangereuse la conduite de véhicules et l’utilisation de machines. Eviter la prise de
boissons alcoolisées et de médicaments contenant de l’alcool.
Associations à prendre en compte :
• Antihypertenseurs : effet antihypertenseur et risque d’hypotension orthostatique majoré (effet
additif) ;
• Autres dépresseurs du système nerveux central : dérivés morphiniques (analgésiques,
antitussifs et traitements de substitution) ; barbituriques ; benzodiazépines ; anxiolytiques autres
que benzodiazépines : carbamates, captodiame, étifoxine ; hypnotiques ; antidépresseurs sédatifs ;
antihistaminiques H1 sédatifs ; antihypertenseurs centraux ; baclofène ; thalidomide.
Majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuse la conduite de
véhicules et l’utilisation de machines.
GROSSESSE ET ALLAITEMENT
Sans objet, médicament indiqué en cas de ménopause confirmée.
EFFETS SUR L’APTITUDE A CONDUIRE DES VEHICULES ET A UTILISER DES
MACHINES
L’attention des conducteurs de véhicules et des utilisateurs de machines sera attirée sur les risques de
risques de somnolence attachés à l’emploi de ce médicament.
EFFETS INDESIRABLES
Troubles neuropsychiques :
• Dyskinésies précoces (torticolis spasmodique, crises oculogyres, trismus) ;
• Syndrome extrapyramidal :
- akinétique avec ou sans hypertonie, et cédant partiellement aux antiparkinsoniens
anticholinergiques,
- hyperkinéto-hypertonique, excito-moteur,
- akathisie ;
• Très rares dyskinésies tardives rapportées au cours de cures prolongées ;
• Sédation ou somnolence ;
• Très rares syndromes de sevrage avec ou sans anxiété, syndrome dépressif avec ou sans anxiété ;
voire anxiété isolée, notamment entre 2 cures ou à l’arrêt du traitement.
Troubles endocriniens et métaboliques :
• Hyperprolactinémie réversible à l’arrêt du traitement ;
• Prise de poids.
Troubles neuro- végétatifs :
• Hypotension orthostatique.
SURDOSAGE
- Crises dyskinétiques neuromusculaires localisées ou généralisées ;
- Syndrome parkinsonien gravissime, coma. : Traitement symptomatique, réanimation sous étroite
surveillance respiratoire et cardiaque continue (risque d’allongement de l’intervalle QT) qui sera
poursuivie jusqu’à rétablissement du patient.
PROPRIÉTÉS PHARMACOLOGIQUES
Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIPSYCHOTIQUE NEUROLEPTIQUE BENZAMIDE
Code ATC : N05AL06 (système nerveux)
Neuroleptique qui présente expérimentalement une activité antagoniste de la dopamine et une activité
antigonadotrope. Il stimule la sécrétion de prolactine.
Le véralipride est dénué de toute activité hormonale ou stéroïdienne.
Propriétés pharmacocinétiques
Le véralipride est bien absorbé par voie orale ; la biodisponibilité des gélules est en moyenne de 80%.
La concentration plasmatique maximale est obtenue 2,5 heures après l’administration. La demi-vie
d’élimination est de 4 heures. La clairance totale du véralipride est de 775 ml/min., la clairance totale
étant de 250 ml/min en moyenne.
DONNÉES PHARMACEUTIQUES
Durée de conservation : 3 ans à une température ne dépassant pas 30°c.
Liste I - A.M.M. 323 204.7 (1979, révisée 2006) Mise sur le marché 1980
Prix : 8,41 € (20 gélules) Remb Séc. Soc. à 35 % - Agréé Collect.
Laboratoires Grünenthal
100-102, rue de Villiers - 92309 LEVALLOIS-PERRET cedex - Tel. 01 41 49 45 80
Le fichier utilisé pour vous transmettre ces informations a été déclaré à la CNIL. En application des
dispositions des articles 32 et suivants de la loi « Informatique et libertés » du 6 août 2004, vous
disposez d’un droit d’accès et de rectification, de vos coordonnées, auprès du Pharmacien
Responsable de notre Laboratoire.
LES RECOMMANDER CE luchador: Review "Détermination de l'Agence Européenne des Médicaments 23 juillet 2007 AGREAL-VERALIPRIDE".TRADUCTOR INTERNET:Agreal ® 100 mg cápsulas Pie de imprenta revisado.
24 février 2006
AGREAL® 100 mg gélules
(véralipride)
FORMA Y PRESENTACIÓN Cápsula (verde): la casilla 20, en blister (PVC / aluminio) COMPOSICIÓN Véralipride (DCI): 100 mg por cápsula o 2 g por caja Excipientes: lactosa, almidón, celulosa microcristalina, lauril sulfato de sodio, metilcelulosa, talco, estearato de magnesio. Sobre de la cápsula: gelatina, dióxido de titanio, índigo, amarillo quinoleína. Calibrado: N º 2. Sodio: 82 g.
INDICACIONES TERAPÉUTICAS Tratamiento de lavado discapacitante asociada con manifestaciones psicológicas fonctionnelles de la menopausia confirmada. DOSIFICACIÓN Y ADMINISTRACIÓN Por vía oral. Reservado para los adultos. La dosis es de 100 mg, una cápsula por día, por curso de 20 días por mes. La duración del tratamiento se limita a 3 meses.

CTJ: 0,42 €. Contraindicaciones Este medicamento está contraindicado en los siguientes casos: - Hipersensibilidad a véralipride o de cualquiera de los componentes del producto; - Prolactino dependientes sabe o se sospecha de tumor, por ejemplo, en adenoma hipofisario prolactina; - Feocromocitoma, conocidos o presuntos; - En combinación con agonistas dopaminérgicos (amantadina, apomorfina, bromocriptina, cabergolina, entacapona, lisuride, pergolida, piribedil, pramipexol, quinagolide, ropinirol) (ver interacciones); - En asociación con neurolépticos antipsicóticos y neurolépticos antieméticos (véase Interacciones; - Parkinson.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO:
Agreal es un neurolépticos. Puede causar disquinesias y síndromes de Parkinson. Es imprescindible para detener el tratamiento.
Agreal no es un reemplazo de estrógeno. No corregir el hypoestrogénie la menopausia y no puede en modo alguno constituye un tratamiento de los efectos de esta deficiencia en especialmente en el hueso y la mucosa genital. Efectos de la clase - Síndrome maligno: Como con otros neurolépticos, la incidencia de síndrome maligno (hipertermia, rigidez muscular, neurovegetative trastornos, trastornos de la conciencia, el aumento de CPK) es posible.
En caso de hipertermia, particularmente con altas dosis diarias, el tratamiento debe ser detenido. - Prolongación del intervalo QT: este efecto, conocido por potenciar el riesgo de disturbios ritmo ventricular grave tipo de torsades de pointes, se incrementa por la existencia de una bradicardia (menos de 55 latidos por minuto) y hipopotasiemia, QT largo congénito o adquirido (asociado a un fármaco cada vez más el intervalo QT).
Por lo tanto, antes de garantizar la administración de los factores que pueden promover aparición de estas arritmias. Se recomienda realizar un ECG en la investigación inicial de los pacientes a ser tratados por un neurolépticos. -
La disquinesias tardías se observaron durante el tratamiento prolongado, la antiparkinsoniana Los anticolinérgicos son, sin acción o puede causar un empeoramiento. - Seguimiento de mama se recomienda debido al riesgo de hiperprolactinemia en algunos pacientes. Un síndrome de abstinencia, con o sin ansiedad, un síndrome depresivo, con o sin ansiedad, incluso aislamiento ansiedad puede ocurrir entre el 2 de tratamiento o interrumpir el tratamiento. El tratamiento debe ser reanudado, luego poco a poco el tratamiento. El seguimiento del tratamiento por véralipide deben reforzarse: - En sujetos con una historia de convulsiones debido a la posibilidad de reducir epileptogenic umbral; - En pacientes ancianos con una mayor susceptibilidad a la hipotensión ortostática y la sedación. En ausencia de datos, este fármaco no está recomendado en la insuficiencia renal. Debido a la presencia de lactosa, la droga no debe utilizarse en casos de galactosemia congénita de síndrome de malabsorción de glucosa y galactosa o deficiencia de lactasa.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIONES
Asociaciones contra inapropiado: • agonistas dopaminérgicos (amantadina, apomorfina, bromocriptina, cabergolina, entacapona, lisuride, pergolida, piribedil, pramipexol, quinagolide, ropinirol) Antagonismo recíproco de los agonistas dopaminérgicos y los neurolépticos.
Neurolépticos antipsicóticos • Los neurolépticos antieméticos Aumento de la adversos neurológicos y psicológicos.
Asociación no se recomienda: • Alcohol: El alcohol aumenta el efecto sedante de los neurolépticos. Deterioro de la vigilancia puede hacer peligrosa la conducción y manejar maquinaria. Evite tomar bebidas alcohólicas y medicamentos que contengan alcohol. Asociaciones a tener en cuenta: • Antihipertensivos: efecto antihipertensivo y riesgo de hipotensión ortostática aumentado (efecto aditivo); • Otros depresores del sistema nervioso central: derivados de la morfina (analgésicos, tos y el tratamiento de sustitución), barbitúricos, benzodiazepinas, otros ansiolíticos que las benzodiazepinas: carbamatos, captodiame, ETIFOXINE, hipnóticos, sedantes, antidepresivos; antihistamínicos H1 sedantes, antihipertensivos centrales, baclofeno, talidomida. Aumento de la depresión central. Deterioro de la vigilancia puede hacer peligrosa la conducción de vehículos y maquinaria.
EMBARAZO Y LACTANCIA MATERNA No procede de drogas se indica en casos confirmados de la menopausia. Efectos sobre la capacidad para conducir y utilizar MÁQUINAS La atención de los conductores y usuarios de las máquinas se extraerán a los riesgos de Somnolencia adjunta al uso de este medicamento.
EFECTOS INDESEABLES:
Neuropsychic trastornos: • A principios de discinesia (tortícolis espasmódica, oculogyres crisis, trismus); • síndrome extrapiramidal: - Akinetic con o sin hipertensión, y en parte al cedente antiparkinsoniana anticolinérgicos - Hipertónica-hyperkinéto, excito-motoras - Acatisia; • Muy raros disquinesias tardías informó durante el tratamiento prolongado; • Sedación o somnolencia; • Muy raras, con o sin síndrome de ansiedad, síndrome depresivo, con o sin ansiedad; ansiedad o aislamiento, especialmente entre el 2 de tratamiento o interrumpir el tratamiento. Endocrinas y metabólicas: • hiperprolactinemia reversible después de la interrupción del tratamiento; • Aumento de peso.
Trastornos neuro-vegetativo: • hipotensión.
SOBREDOSIS - Crisis dyskinetic localizado o generalizado neuromusculares; - Graves parkinsonianas síndrome de coma. : Tratamiento sintomático, la reanimación de cerca monitorización cardíaca y respiratoria continua (riesgo de prolongación de QT), que se continuó hasta que el paciente se recupere. PROPIEDADES FARMACOLÓGICAS Propiedades farmacodinámicas Grupo farmacoterapéutico: neurolépticos antipsicóticos benzamida Código ATC: N05AL06 (sistema nervioso) Neurolépticos que este experimentalmente un antagonista de la dopamina y un antigonadotrope. Estimula la secreción de prolactina. El véralipride carece de cualquier actividad o de la hormona esteroide. Propiedades farmacocinéticas El véralipride se absorbe bien por vía oral, la biodisponibilidad de las cápsulas es en promedio del 80%. La concentración plasmática máxima se obtiene a 2,5 horas después de la administración. La vida media eliminación de 4 horas. El total de la liquidación de véralipride es 775 ml / min., El total de la liquidación ser de 250 ml / min en promedio. FARMACÉUTICA Duración: 3 años a una temperatura no superior a 30 ° c. Lista I - A.M.M. 323 204,7 (1979, revisada en 2006) Marketing en 1980 Precio: 8,41 € (20 cápsulas) Séc Reembolso. Soc. 35% - de acuerdo Recoger. Laboratorios Grünenthal 100-102, rue de Villiers - 92309 Levallois-Perret cedex - Tel. 01 41 49 45 80 El archivo utilizado para enviar esta información ha sido declarada a la CNIL. De conformidad con la disposiciones de los artículos 32 y siguientes de la ley "Informatique et Libertés" del 6 de agosto de 2004, que tienen el derecho de acceso y rectificación de sus datos personales, de la farmacia Responsables de nuestro laboratorio.
LES RECOMIENDA ESTA LUCHADORA: REVISAR O LEER "DETERMINACIÓN DE LA AGENCIA EUROPEA DEL MEDICAMENTO: 23 JULIO 2007 AGREAL-VERALIPRIDE".
 s have been recently filed. There can be no assurance that cases decided to date will berepresentative of future decisions and that additional claims will not be filed in Spain or other countries.
s have been recently filed. There can be no assurance that cases decided to date will berepresentative of future decisions and that additional claims will not be filed in Spain or other countries.




 __________________________________________________
__________________________________________________ __________________________________________________
__________________________________________________ Tras la unión de un receptor acoplado a proteína G (GCPR) el estado conformacional del complejo ternario puede producir diferentes tipos de respuesta según las características del ligando y del estado conformacional del receptor y la proteína G a la que se ha acoplado: agonismo, falta de respuesta o agonismo parcial (impidiendo la acción de otros agonistas). Nótese que el antagonista en todos los casos se comporta de la misma manera. __________________________________________________
Tras la unión de un receptor acoplado a proteína G (GCPR) el estado conformacional del complejo ternario puede producir diferentes tipos de respuesta según las características del ligando y del estado conformacional del receptor y la proteína G a la que se ha acoplado: agonismo, falta de respuesta o agonismo parcial (impidiendo la acción de otros agonistas). Nótese que el antagonista en todos los casos se comporta de la misma manera. __________________________________________________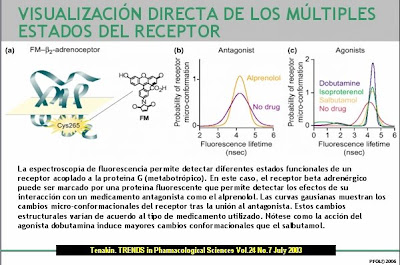 __________________________________________________
__________________________________________________ __________________________________________________
__________________________________________________ El Ácido gama amino butírico (GABA) es un producto del metabolismo del glutamato que posee todas las características propias de los neurotransmisores: se almacena en vesículas, se libera tras la despolarización sináptica, se une a receptores postsinápticos y presinápticos, puede ser recaptado por proteínas transportadoras en la membrana presináptica y es metabolizado por enzimas especializadas en células de la glia.
El Ácido gama amino butírico (GABA) es un producto del metabolismo del glutamato que posee todas las características propias de los neurotransmisores: se almacena en vesículas, se libera tras la despolarización sináptica, se une a receptores postsinápticos y presinápticos, puede ser recaptado por proteínas transportadoras en la membrana presináptica y es metabolizado por enzimas especializadas en células de la glia.
 En resúmen. Diferentes sistemas de neurotransmisión actúan en conjunto provenientes de diversas áreas subcorticales para regular las funciones corticales como la integración de la información, la cognición, el pensamiento, el afecto, al emoción, etc.
En resúmen. Diferentes sistemas de neurotransmisión actúan en conjunto provenientes de diversas áreas subcorticales para regular las funciones corticales como la integración de la información, la cognición, el pensamiento, el afecto, al emoción, etc. Enzimas especializadas son indispensales en la formación de nuevos neurotransmisores como las aminas. La tirosina hidroxilasa permite la formación de dopamina; la dopamina beta hidroxilasa, la formación de noradrenalina y la triptófano hidroxilasa, la formación de serotonina.
Enzimas especializadas son indispensales en la formación de nuevos neurotransmisores como las aminas. La tirosina hidroxilasa permite la formación de dopamina; la dopamina beta hidroxilasa, la formación de noradrenalina y la triptófano hidroxilasa, la formación de serotonina. Como se dijo, la interacción de múltiples sistemas de neurotransmisión permite la modulación de su actividad. Es por eso que encontramos receptores noradrenérgicos en terminales serotoninérgicas o receptores serotoninérgicos en terminales GABAérgicas, por ejemplo.
Como se dijo, la interacción de múltiples sistemas de neurotransmisión permite la modulación de su actividad. Es por eso que encontramos receptores noradrenérgicos en terminales serotoninérgicas o receptores serotoninérgicos en terminales GABAérgicas, por ejemplo. Las vías noradrenérgicas proceden del locus ceruleus en la protuberancia y tienen una proyección similar descrita para la serotonina.
Las vías noradrenérgicas proceden del locus ceruleus en la protuberancia y tienen una proyección similar descrita para la serotonina. Las vías serotoninérgicas proceden de los núcleos del rafe en la protuberancia y se proyectan hacia la médula espinal regulando varias funciones vegetativas como las gastrointestinales) o se proyectan hacia la corteza cerebral y estructuras subcorticales regulando funciones cognoscitivas y afectivas.
Las vías serotoninérgicas proceden de los núcleos del rafe en la protuberancia y se proyectan hacia la médula espinal regulando varias funciones vegetativas como las gastrointestinales) o se proyectan hacia la corteza cerebral y estructuras subcorticales regulando funciones cognoscitivas y afectivas. (a) La cantidad de neurotransmisores contenidos en una vesícula está influenciado por la concentración del mismo en la terminal presináptica y (b) por la eficiencia y eficacia del transportador vesicular. (c) El aumento en el contenido de neurotransmisores llevará al alargamiento de la vesícula para mantener una concentración de ellos constante. (d) El número de vesículas fusionadas y (e) la velocidad de descarga de los neurotransmisores controlará la concentración de éstos en el espacio sináptico. Por último, la concentración de los neurotransmisores cerca de la superficie del receptor postsináptico está determinada por (g) el tamaño de la hendidura sináptica y (f) la posición del grupo de receptores.
(a) La cantidad de neurotransmisores contenidos en una vesícula está influenciado por la concentración del mismo en la terminal presináptica y (b) por la eficiencia y eficacia del transportador vesicular. (c) El aumento en el contenido de neurotransmisores llevará al alargamiento de la vesícula para mantener una concentración de ellos constante. (d) El número de vesículas fusionadas y (e) la velocidad de descarga de los neurotransmisores controlará la concentración de éstos en el espacio sináptico. Por último, la concentración de los neurotransmisores cerca de la superficie del receptor postsináptico está determinada por (g) el tamaño de la hendidura sináptica y (f) la posición del grupo de receptores. La comunicación sináptica consiste en la transmisión electroquímica de señales entre dos o más neuronas. Para ello, la despolarización de la neurona presináptica permite la liberación de los neurotransmisores almacenados en las vesículas presinápticas. Los neurotransmisores se unirán a receptores post o presinápticos y serán recapturados por proteínas transportadoras presinápticas para ser realmacenados en las vesículas o destrudos por enzimas.
La comunicación sináptica consiste en la transmisión electroquímica de señales entre dos o más neuronas. Para ello, la despolarización de la neurona presináptica permite la liberación de los neurotransmisores almacenados en las vesículas presinápticas. Los neurotransmisores se unirán a receptores post o presinápticos y serán recapturados por proteínas transportadoras presinápticas para ser realmacenados en las vesículas o destrudos por enzimas.












